Die Validierung und Qualifizierung von Reinräumen ist entscheidend für eine wirksame Kontaminationskontrolle.
Im August 2022 wurde eine neue Revision des GMP-Annex 1 der EU veröffentlicht, in der neue Vorschriften für sterile Arzneimittel und deren Herstellung vorgeschlagen werden. Diese Version von 2022 ersetzt den letzten Entwurf von 2020 und den bestehenden Anhang 1 von 2008. In der aktualisierten Revision werden die Themen Validierung und Qualifizierung noch stärker betont. Im neuen Annex 1 werden die spezifischen Bedürfnisse und Anforderungen an Räumlichkeiten, Ausrüstung, Versorgungseinrichtungen und Personal detaillierter beschrieben, um eine Anleitung für die Herstellung steriler Produkte zu geben.
Warum ist die Validierung und Qualifizierung von Reinräumen in einem pharmazeutischen Prozess so wichtig?
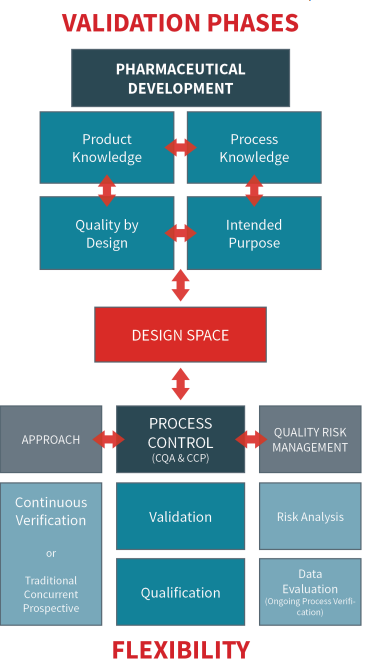 Mit der Aufnahme der Reinraumvalidierung und -qualifizierung in die flexiblen und wissenschaftlich fundierten pharmazeutischen Prozesse, die in der Revision von Annex 1 für 2022 vorgeschlagen werden, ist eine umfassende Überprüfung der pharmazeutischen Entwicklung unerlässlich. Das Ziel der pharmazeutischen Entwicklung besteht darin, ein Qualitätsprodukt und ein Herstellungsverfahren zu entwerfen, das die beabsichtigte Leistung des Endprodukts beständig erbringt. Die aus der Herstellungserfahrung und den pharmazeutischen Entwicklungsstudien gewonnenen Informationen und Kenntnisse liefern wissenschaftliche Erkenntnisse, die die Festlegung des Gestaltungsraums unterstützen – eine mehrdimensionale Kombination und Interaktion von Eingangsvariablen (z. B. Materialeigenschaften und Prozessparameter, die nachweislich die Qualität gewährleisten).
Mit der Aufnahme der Reinraumvalidierung und -qualifizierung in die flexiblen und wissenschaftlich fundierten pharmazeutischen Prozesse, die in der Revision von Annex 1 für 2022 vorgeschlagen werden, ist eine umfassende Überprüfung der pharmazeutischen Entwicklung unerlässlich. Das Ziel der pharmazeutischen Entwicklung besteht darin, ein Qualitätsprodukt und ein Herstellungsverfahren zu entwerfen, das die beabsichtigte Leistung des Endprodukts beständig erbringt. Die aus der Herstellungserfahrung und den pharmazeutischen Entwicklungsstudien gewonnenen Informationen und Kenntnisse liefern wissenschaftliche Erkenntnisse, die die Festlegung des Gestaltungsraums unterstützen – eine mehrdimensionale Kombination und Interaktion von Eingangsvariablen (z. B. Materialeigenschaften und Prozessparameter, die nachweislich die Qualität gewährleisten).
Die Arbeit innerhalb des Designraums wird nicht als Veränderung betrachtet. Das Verlassen des Auslegungsraums ist eine Änderung und würde normalerweise ein behördliches Änderungsverfahren nach der Zulassung einleiten. Studien zur Prozessentwicklung sollten die Grundlage für alle Anforderungen an die Prozesskontrolle bilden. Ebenso sollten Prozessverbesserungen durch verschiedene Qualitätsaspekte unterstützt werden, darunter die Qualifizierung der Ausrüstung und die Prozessvalidierung (oder die kontinuierliche Prozessverifizierung, ein alternativer Ansatz, bei dem die Leistung des Herstellungsprozesses kontinuierlich überwacht und bewertet wird).
QRM (Qualitätsrisikomanagement) sollte als ein wichtiges Instrument der allgemeinen Kontrolle des Herstellungsprozesses betrachtet werden. Wenn QRM-Grundsätze auf die Validierung angewandt werden, unterstützt dies die Robustheit des Prozesses im Hinblick auf die Reproduzierbarkeit innerhalb der festgelegten Spezifikationen. Durch die Anwendung von QRM-Prinzipien werden wissenschaftliche Begründungen und eine Risikobewertung als kritische Aspekte bei der Betrachtung der Rohdaten und der Qualität des Produkts für den Endkunden wirksam einbezogen. Die Qualifizierung als Teil der Prozessvalidierung erzeugt Daten über kritische Systeme (z. B. Ausrüstung, Personal, Materialien usw.), die zur Bewertung des Prozesses und zur Dokumentation seiner Qualität im Laufe der Zeit (und während des Routinebetriebs) verwendet werden können. Installations-, Betriebs- und Leistungsnachweise für ein Gerät oder System garantieren, dass die Benutzeranforderungen zur Sicherung der Produktqualität für einen bestimmten Zweck erfüllt werden.
Die Anwendung eines systematischen Quality-by-Design-Ansatzes in der Entwicklung und die Anwendung eines Qualitäts-Risikomanagement-Ansatzes im Herstellungsprozess (in Verbindung mit einem geeigneten pharmazeutischen Qualitätssystem) bieten Möglichkeiten zur Verbesserung wissenschaftlicher und risikobasierter Regulierungsmethoden. Ein besseres Verständnis des Produkts und seines Herstellungsprozesses (systematische Bewertung) kann eine Grundlage für flexiblere Ansätze schaffen.
Erfahren Sie mehr… Füllen Sie das Formular aus, um das vollständige Dokument herunterzuladen.

