
Wie man eine Strategie zur Kontaminationskontrolle für die Pharmaproduktion entwickelt
Wenn wir darüber nachdenken, wie wir eine Kontaminationskontrollstrategie aufbauen können, müssen wir mit dem Kontext beginnen. Seit der industriellen Herstellung von synthetischen Arzneimitteln Ende des 19. Jahrhunderts hat sich die pharmazeutische Massenproduktion mit raschen Fortschritten in den Bereichen Technologie, Prozesskontrolle und Sterilitätsanforderungen stark weiterentwickelt. Doch trotz dieser Verbesserungen kommt es immer noch regelmäßig zu Rückrufaktionen, die erhebliche Auswirkungen sowohl auf den Hersteller als auch auf den Verbraucher haben, weshalb die weltweite Regulierung der Branche so streng ist. Die Umgebungsüberwachung (EM – Environmental Monitoring) ist eine Facette des Gesamtbildes der aktuellen guten Herstellungspraxis (cGMP – current good manufacturing practices), die für die Sicherheit der menschlichen Gesundheit standardisiert wurde.
In einem typischen Reinraum erfolgt die EM in Form der Überwachung nicht lebensfähiger und lebensfähiger Partikel, um einen zuverlässigen Kontrollzustand in der Produktion aufrechtzuerhalten. Die Grenzwerte für die Klassifizierung oder den Grad“ eines Bereichs sind sowohl in den FDA-Richtlinien für sterile Arzneimittel, die unter aseptischen Bedingungen hergestellt werden, als auch im EU GMP Annex 1 2020 Draft der Europäischen Kommission festgelegt.
- Lebensfähige Partikel sind lebende Organismen wie Bakterien, Schimmel- und Hefepilze.
- EU-GMP-Grenzwerte finden Sie in Tabelle 7, Maximale Auslösewerte für die Kontamination durch lebensfähige Partikel.
- FDA cGMP-Grenzwerte finden Sie in Tabelle 1, Luftklassifizierungen.
- Nicht lebensfähige Partikel enthalten keine lebenden Organismen, sondern dienen als Transportmittel für lebensfähige Partikel.
- EU-GMP-Grenzwerte siehe Tabelle 6, Grenzwerte für die Konzentration luftgetragener Partikel zur Überwachung der Kontamination mit nicht lebensfähigen Partikeln.
- FDA cGMP-Grenzwerte finden Sie in Tabelle 1, Luftklassifizierungen.
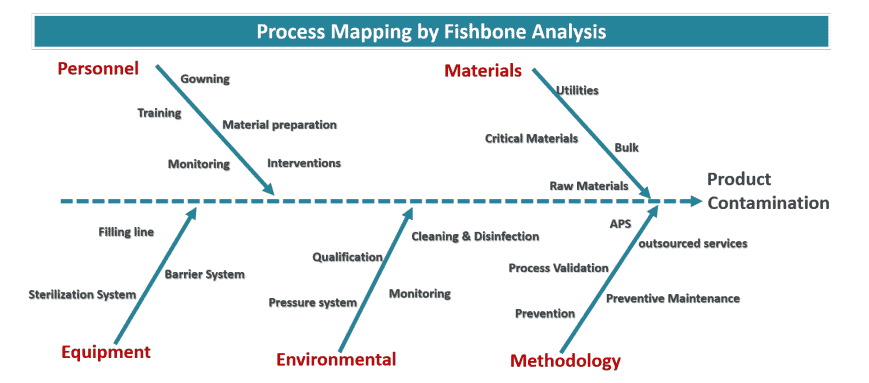
In der Vergangenheit lag der Schwerpunkt auf Probenahmeverfahren zur Messung potenzieller Verunreinigungen: Partikelzähler, aktive Luftkeimsammler, Petrischalen und Tupfer zur Oberflächenüberwachung. Die biologische Belastung des Schüttguts und die Unversehrtheit der Filter wurden ebenfalls getestet, um die Erkennung mikrobiologischer Verunreinigungen während des Produktionsprozesses zu verbessern. Dieser Ansatz wurde umgestaltet, um zu verhindern und zu kontrollieren, dass potenzielle Kontaminationen den Punkt erreichen, an dem es kein Zurück mehr gibt: das Produkt. Sobald eine Kontamination auftritt, gibt es kein kosteneffizientes Entfernungsprogramm, um die Produktion fortzusetzen, was die Bestimmung der Quellen umso wichtiger macht. Dies wird erreicht durch:
- Einführung von Quality by Design in den Fertigungsbereich.
- Anwendung des Qualitätsrisikomanagements zur Ermittlung der kritischen Kontrollpunkte (CCPs).
- Anhand der CCPs werden die Prozessphasen identifiziert, in denen Abhilfemaßnahmen zur Kontrolle der identifizierten Risiken erforderlich sind.
Die gemeinsame Durchführung von Kontrollen wird als Kontaminationskontrollstrategie (CCS) bezeichnet.
Auch in diesem Papier
- Definition der Kontaminationskontrollstrategie (CCS)
- Suche nach den Ursachen der Kontamination
- Gestaltung eines Reinraums
- ….Viel mehr
Dieses Papier wurde in Verbindung mit dem Webinar „Überlegungen und Schritte zum Aufbau einer Kontaminationskontrollstrategie“ erstellt. Ein FAQ-Dokument finden Sie hier. Es wurden viele durchdachte Fragen zu den Anforderungen an die Zählung nicht lebensfähiger Partikel in Reinräumen und zur Platzierung von Probenahmen im Zusammenhang mit der Prozessgestaltung gestellt. 
